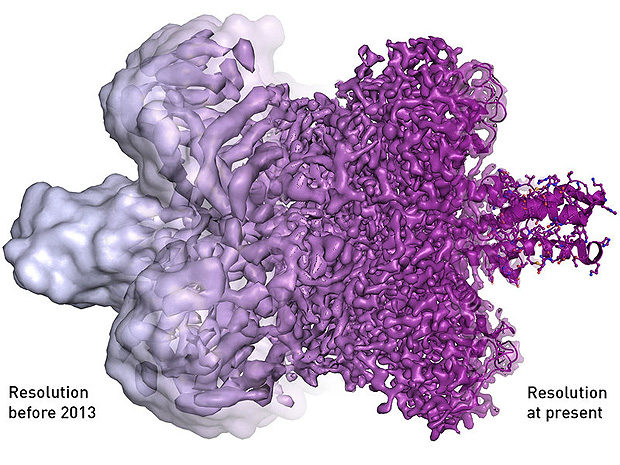
As fotografias, filmes e movimentos da vida foram os premiados no Nobel de Química deste ano. Se estiver achando muito poético, o nome técnica premiada é criomicroscopia eletrônica.
Os laureados foram Jacques Dubochet, da Universidade de Lausanne, Joachim Frank, da Universidade Columbia e Richard Henderson, da Universidade de Cambridge.
"Achava que o prêmio iria para o Crispr [mecanismo de edição genética]", afirmou Joachim Frank à Folha. "Pelo sotaque sueco eu soube o que era", disse, com a tranquilidade de quem ganhou um Nobel nesta quarta (4).
Com a criomicroscopia é possível congelar moléculas em meio a processos bioquímicos, e, dessa forma, visualizar e analisar com precisão a superfície delas e o funcionamento do maquinário orgânico. A técnica, por exemplo, foi utilizada no estudo do vírus da zika durante o surto de microcefalia no Brasil.
O método é uma evolução da microscopia eletrônica –área de pesquisa Henderson–, que permitia, a partir do uso de um feixe de elétrons, a visualização de minúsculas estruturas e até mesmo a posição individual de átomos em equipamentos de alta resolução.
Um dos problemas do microscópio eletrônico é o fato de o feixe de elétrons incinerar o material biológico analisado, como o DNA e proteínas. Além disso, o microscópio eletrônico necessita de vácuo para seu funcionamento, o que também danifica as moléculas vivas observadas, secando-as e tornando menos precisas as imagens obtidas.
Mesmo com todos esses problemas, Henderson foi capaz de, pela primeira vez, conseguir apresentar a imagem da estrutura atômica de uma proteína.
Ao mesmo tempo, Frank, da Universidade de Columbia, trabalhava em uma forma de gerar imagens tridimensionais de moléculas.
Para isso, o cientista se utilizou do microscópio eletrônico e das imagens bidimensionais que este gerava. Frank, então, jogava essa informação em um software desenvolvido por ele que, a partir do reconhecimento dos diferentes ângulos da molécula analisada, conseguia criar uma imagem 3D da partícula.
Mesmo assim, persistiam os problemas de análise de material vivo pela microscopia eletrônica. E é aí que entra Dubochet.
VIDRO
Para transpor os problemas da análise com microscópios eletrônicos, o pesquisador da Universidade de Lausanne teve a ideia de congelar em altíssima velocidade o material orgânico analisado. Para isso, usou o processo conhecido como vitrificação, no qual o material se 'solidifica" ainda em estado líquido.
Forma-se, então, o vítreo, material que parece sólido mas é fluído -com moléculas desordenadas. As pesquisas se uniram conforme Frank passou a utilizar a técnica de "fazer vidro" de Dubochet para obter imagens 3D.
As pesquisas se uniram conforme Frank passou a utilizar a técnica de "fazer vidro" de Dubochet para obter imagens 3D.
"A criomicroscopia é basicamente conseguir uma foto, com resolução atômica, de uma espécie biológica", afirma Guilherme Oliveira, pesquisador do Centro Nacional de Biologia Estrutural e Bioimagem (Cenabio), da UFRJ, que atualmente faz um pós-doc sobre a técnica na Universidade da Virgínia, nos EUA.
Segundo Oliveira, em 3 segundos é possível fazer entre 100 e 200 dessas "fotos".
Porém, a precisão e qualidade dos modelos 3D obtidos inicialmente -até entre 2012 e 2013- ainda eram baixas, e as imagens obtidas lembravam uma espécie de gosma.
Com a melhora na resolução dos microscópios, a massa disforme ganhou contornos mais precisos. "E daí?", você pode estar se perguntando.
DOENÇAS
A visualização precisa por criomicroscopia eletrônica das membranas (os contornos) das proteínas dá um passo além do que havia sido alcançado por outras tecnologias de imagem –como a cristalografia de raios X. As aplicações médicas da nova técnica são o destaque.
"Conhecendo a estrutura de uma molécula viral, você consegue desenvolver uma intervenção terapêutica para anular o efeito do patógeno", afirma Oliveira, referindo-se às estruturas da membrana dos patógenos, costumeiros alvos de drogas.
Esse conhecimento também permite o encapsulamento de fármacos e o direcionamento deles para as áreas e moléculas onde deve agir.
Rodrigo Portugal, pesquisador do CNPEM (Centro Nacional de Pesquisas em Energia e Materiais) –um dos únicos locais no Brasil a trabalhar com criomicroscopia para análise de biologia estrutural– diz que a técnica é importante para compreender o funcionamento geral dos organismos. "A proteína é uma máquina que faz algo. Ela tem diferentes conformações e, se vejo só uma delas, estou vendo uma parte da história. Preciso ver as outras para ter a narrativa completa", diz.
"As biomoléculas estão na base do funcionamento da vida. Técnicas que nos permitem entender o funcionamento disso vão ajudar a compreender melhor a dinâmica da vida", afirma Portugal.
Além disso, por se tratar de um processo relativamente barato, os pesquisadores conseguem fazer "filmes" da engrenagem molecular –com séries de imagens congeladas de diferentes partes da ação, o que ajuda a entender a interação entre moléculas.
Contudo, ainda há muito a evoluir.
Segundo o laureado Frank, a resolução dos microscópios pode melhorar ainda mais, possibilitando visualizações ainda mais precisas. O tempo é outro problema.
"Nós não conseguimos ver agora algumas estruturas intermediárias [que surgem no meio dos processos do maquinário bioquímico e desaparecem em um curtíssimo espaço de tempo], que propiciam mais informações sobre o mecanismo", diz Frank.
"Quando você analisa todas as estruturas, há diversos passos faltando. Você não consegue realmente analisar todo o processo ainda", afirmou o novo nobelista.
Por isso, para os próximos passos, a ideia é "fazer filmes das moléculas executando seu trabalho, o que não era possível antes".
-
IMAGEM VÍTREA
Entenda a técnica de criomicroscopia eletrônica, que rendeu o Nobel de Química de 2017
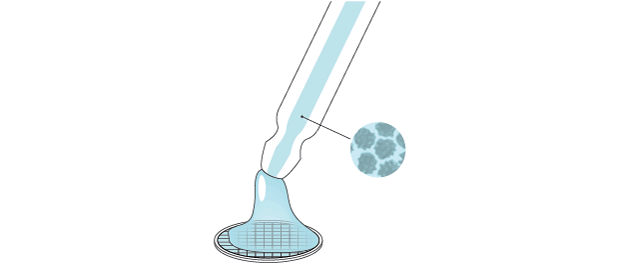 |
Amostra líquida contendo partículas orgânicas é colocada sobre uma trama metálica
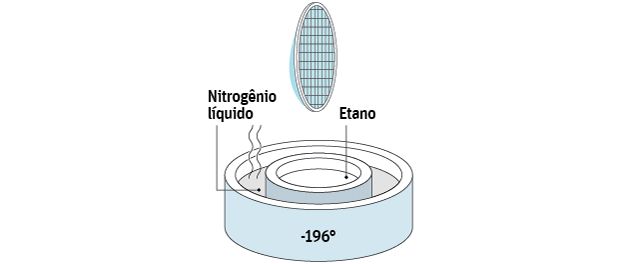 |
A trama é mergulhada em etano a -190°C, que por sua vez mantém a baixa temperatura por estar em nitrogênio líquido a -196°C.
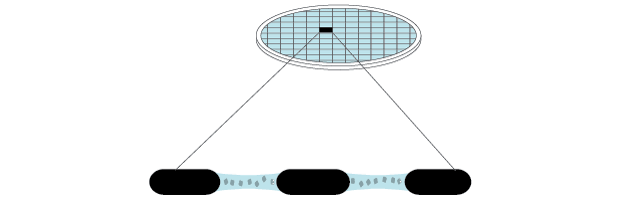 |
O processo causa a vitrificação da amostra nos buracos da trama, possibilitando assim a observação das moléculas orgânicas
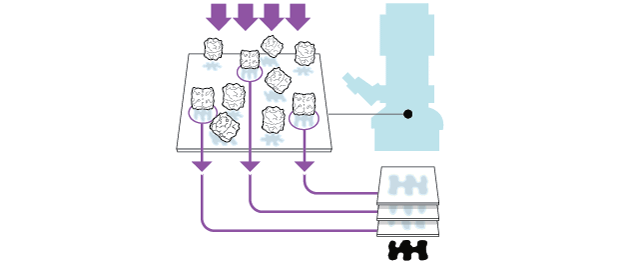 |
As proteínas vitrificadas são atingidas por feixes de elétrons, deixando uma "sombra"
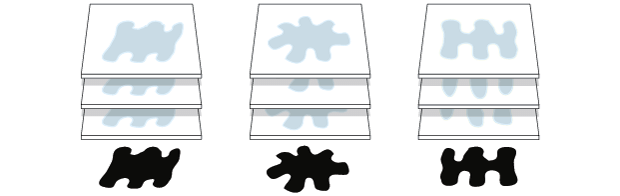 |
Software agrupa as "sombras" semelhantes e, a partir de milhares delas, consegue gerar imagens 2D em alta resolução
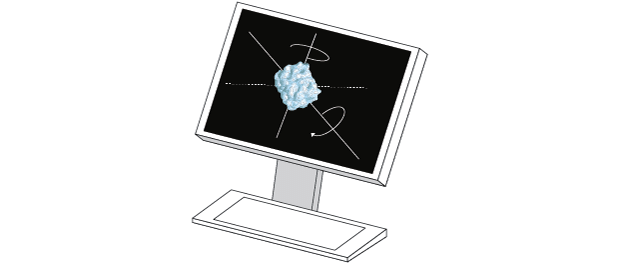 |
O programa analisa todas as imagens 2D geradas e, ao agrupá-las e analisá-las, gera uma imagem 3D em alta resolução
-
INDICAÇÃO E GANHADORES
Este ano houve um aumento na premiação e os laureados recebem 9 milhões de coroas suecas (aproximadamente R$ 3,5 milhões). O dinheiro é fruto de um fundo de mais de 4 bilhões de coroas suecas (em valores atuais) deixado pelo pai do prêmio, Alfred Nobel (1833-1896), inventor da dinamite e para quem a química foi a principal área de conhecimento ligada a seu trabalho.
Além da premiação em dinheiro, os laureados também recebem uma medalha e um diploma.
Os ganhadores do Nobel são escolhidos pela Academia Real Sueca de Ciências entre candidatos selecionados pelo Comitê do Nobel para Química –composto por cinco membros, além de outros adjuntos.
As indicações para as "semifinais" do prêmio partem de pessoas convidadas a sugerir nomes. Membros da Academia Real Sueca de Ciências, dos Comitês do Nobel para química e física, e laureados de química e física podem indicar pesquisadores ao prêmio.
PEQUENAS MÁQUINAS
O Nobel de Química do ano passado foi para as máquinas moleculares, as menores do mundo. Os premiados foram os cientistas Jean-Pierre Sauvage, J. Fraser Stoddart e Bernard L. Feringa.
A área de pesquisa pode ter um impacto significativo na medicina, com o transporte de medicamentos por nanorobôs. Outras possibilidades são a computação molecular e materiais inteligentes que se adaptam a condições externas –algo comparável às roupas e tênis de Marty McFly, do filme "De Volta para o Futuro".
HISTÓRIA
A láurea é dada para o(a) pesquisador(a) responsável pela "descoberta ou aperfeiçoamento químico mais importante".
Local de nascimento dos vencedores do Nobel
Até o momento, desde 1901 –primeiro ano da premiação–, só quatro mulheres foram laureadas.
Em oito ocasiões, por conta das duas guerras mundiais, o Nobel de Química não foi entregue. Isso ocorreu nos anos de 1916, 1917, 1919, 1924, 1933, 1940, 1941 e 1942.
Entre as pesquisas premiadas estão a descoberta e trabalho com os elementos químicos rádio e polônio (Marie Curie, 1911 –ela também ganhou um Nobel de Física); a pesquisa sobre ligações químicas (Linus Pauling - 1954); e a contribuição para melhor entendimento do DNA (Frederick Sanger, 1980 –foi o segundo Nobel de Química dele).
MEDICINA
O prêmio de fisiologia ou medicina deste ano, entregue nesta segunda (2), foi para os pesquisadores que desvendaram os mecanismos moleculares que controlam os ritmos circadianos –que fazem com que nosso organismo se comporte de forma diferente dependendo da hora do dia.
Os americanos Jeffrey C. Hall, Michael Rosbash e Michael W. Young conseguiram explicar a ação de alguns genes sobre o "relógio interno" de organismos.
FÍSICA
Já o prêmio de física, de forma um pouco mais esperada pela comunidade científica, ficou com os pesquisadores responsáveis pela detecção direta das ondas gravitacionais –confirmando uma predição da Teoria da Relatividade Geral de Einstein. A premiação para pesquisa era esperada desde o ano passado, mas, por uma questão de dias, o estudo não pôde ser indicado ao Nobel.
Os laureados foram Kip Thorne, Rainer Weiss, e Barry Barish, membros da colaboração Ligo (Observatório de Ondas Gravitacionais por Interferômetro a Laser, na sigla em Inglês).
Agenda
5.out (quinta)
Nobel de Literatura
6.out (sexta)
Nobel da Paz
9.out (segunda)
Prêmio de Ciências Econômicas