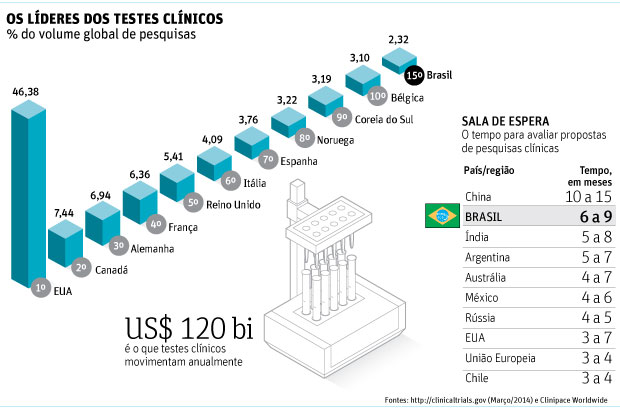
O Brasil é um país com bom potencial para ampliar sua participação no mercado mundial de pesquisas clínicas, mas tem perdido oportunidades em razão da demora dos órgãos reguladores em autorizar projetos, o que envolve três instâncias.
Quando uma empresa farmacêutica se junta a um hospital para testar uma droga, precisa antes ter o protocolo de pesquisa aprovado por um CEP (Conselho de Ética em Pesquisa), normalmente ligado ao próprio centro, que o encaminha à Conep (Comissão Nacional de Ética em Pesquisa). Em paralelo, aspectos de segurança são avaliados pela Anvisa (Agência Nacional de Vigilância Sanitária).
Para João Massud Filho, presidente da Sociedade Brasileira de Medicina Farmacêutica e palestrante do Fórum a Saúde do Brasil, da Folha, essas instâncias atravancam o avanço do setor. "O Brasil não recebe nem 1% do investimento mundial em pesquisa e desenvolvimento na área clínica, embora seja o sétimo maior mercado farmacêutico do mundo", diz.
Antônio Britto, presidente-executivo da Interfarma (Associação da Indústria Farmacêutica de Pesquisa), estima que o sistema brasileiro leve "mais que o dobro do tempo para aprovar novas pesquisas, em comparação com a média mundial". A maior dificuldade é a de entrar em protocolos internacionais.
"Apenas 18 empresas consultadas perderam 112 estudos no ano passado", diz Britto. "Em 61 estudos, quando a resposta foi dada, os trabalhos já estavam em execução no resto do mundo. O mundo não espera pelo Brasil."
O Brasil é o segundo país mais lento para aprovar testes, perdendo apenas para a China (veja quadro abaixo).
| Alex Argozino/Editoria de Arte/Folhapress | ||
 |
CHANCE DE CURA
Em alguns casos, pacientes graves com câncer deixaram de receber terapias experimentais que teriam chance de cura, ainda que remota.
"Em 2012 e 2013, tivemos sete estudos que ainda não chegaram a ser aprovados pela Conep, ou foram aprovados quando o resto do mundo já tinha terminado de recrutar pacientes", diz Helano Freitas, oncologista clínico do A.C. Camargo Cancer Center, de São Paulo. "Nosso estudo aprovado mais rapidamente levou seis meses na Conep. O pior levou 15."
Jorge Venâncio, coordenador da Conep, diz que o problema está sendo resolvido aos poucos. "Quando fizemos um levantamento em setembro de 2013, havia 831 protocolos aguardando parecer, mas no início de março estávamos com 388", diz. "Até maio, estaremos dentro dos dois meses do prazo de resposta previstos na norma."
Esse período, porém, não reflete necessariamente todo o trâmite até a aprovação. Quando há uma pendência a ser resolvida, a documentação volta ao centro de pesquisa, e a contagem recomeça.
Na avaliação da SBPPC (Sociedade Brasileira de Profissionais de Pesquisa Clínica), parte do problema está nos próprios CEPs, que falham em detectar problemas.
"O Conselho Nacional de Saúde autorizou mais de 700 CEPs a funcionar no país todo, mas não fez nenhum movimento para capacitação das pessoas que trabalham neles", diz Conceição Accetturi, presidente da SBPPC.
Existem CEPs de excelência, porém, alguns dos quais até mesmo emprestam pareceristas para a Conep –parte da tática de Venâncio para reduzir a fila de projetos.